


















El Conde Lorenzo Romano Amedeo Carlo Avogadro di Quaregna e di Cerreto (Vercelli), hijo del magistrado Filippo y Anna Vercellone di Biella, nació en Turín el 9 de agosto de 1776 y murió en la misma ciudad el 9 de julio de 1856. El apellido de la familia se remonta a una antigua costumbre, por la que a los abogados que habían prestado servicios a las iglesias se les autorizaba a transmitir a sus herederos la profesión de las leyes. Con eltranscurrir del tiempo, podía suceder que el apellido de algunas familias se perdiera y lo substituyera un simple de Advocatis, del cual derivarían Advocarii, Avogarii, Avogadri.
En 1789 Amedeo Avogadro se graduó en filosofía, algunos años más tarde en jurisprudencia, y en 1796 obtuvo el nombramiento oficial de doctor en ley eclesiástica, que le permitió desempeñarse en el Ufficio dei poveri y posteriormente en la Avvocatura generale.
En 1801 el gobierno de la República Francesa lo nombró secretario de la Prefectura del Departamento del Eridano. Pero en realidad lo que realmente interesaba al joven Avogadro era el campo de las ciencias, y muy particularmente los estudios de física y matemática, enriquecidos por las estimulantes innovaciones de la época. En 1800 llegó a ser discípulo del insigne físico y matemático Vassalli Eandi.
En 1806, tras un período de cinco años de estudio, fue nombrado profesor auxiliar en el Regio Collegio delle Province de Turín y pocos años después (1809), profesor de matemática y física en el Liceo o Collegio de Vercelli, donde conservó su cargo hasta 1819.
Con la creación de la Universidad de Turín, por decreto del rey Víctor Manuel I el 6 de noviembre de 1820, Avogadro asume la dirección de la primera cátedra de física sublime, que desempeñó tan sólo hasta 1821, cuando, a raíz de los movimientos revolucionarios, se suspendieron muchas cátedras universitarias, sin ninguna consideración por los méritos científicos de los respectivos docentes. En realidad, como es sabido, de este modo se deseaba castigar no tanto a las personas, como a la institución universitaria, crisol de ideas de progreso y por ende, de reflexión, es decir castigar ¡a la ciencia! El físico turinés fue designado entonces Mastro Uditore de la Cámara Real de Cuentas. En 1832 Carlo Alberto rehabilitó las cátedras universitarias suspendidas por su predecesor, y Avogadro, dados sus grandes méritos científicos, recuperó su cargo, que desempeñó desde 1834 hasta 1850, año en que cedió la docencia a su discípulo Felice Chiò.
Los biógrafos lo describen como un hombre de temple excepcional, de férrea voluntad y extraordinaria capacidad de dedicación al trabajo. Consolidaba y corroboraba su cultura científica un vasto conocimiento de las letras, la filosofía y los tratados jurídicos. Avogadro dividía su tiempo entre el estudio, la docencia y su familia, y pese al relativo deshogo que le procuraban los éxitos, llevaba un tren de vida moderado, exento de excesos y jactancia. Se encontraba siempre dispuesto a la confrontación, y manifestaba asimismo una particular sensibilidad por la formación científica de los jóvenes estudiantes que le eran encomendados.
 Su amigo Felice Romani, quien le tenía en suma estima, anunciaba la muerte del químico turinés, acaecida en 1856, en lo siguientes términos: Con la bondad del corazón se correspondía en Avogadro la gentileza de su persona: ojos vivaces pero de mirada serena, dulce y expresiva fisonomía, labios elocuentes, trato cortés, modales afectuosos y sinceros; garbo y vigor en gráciles miembros. Religioso sin intolerancia, docto sin pedantería, sabio sin ostentación, enemigo del fasto, despreocupado por la riqueza, sin ambición a los honores, desconocedor de sus méritos y reputación, modesto, sobrio, afectuoso.
Su amigo Felice Romani, quien le tenía en suma estima, anunciaba la muerte del químico turinés, acaecida en 1856, en lo siguientes términos: Con la bondad del corazón se correspondía en Avogadro la gentileza de su persona: ojos vivaces pero de mirada serena, dulce y expresiva fisonomía, labios elocuentes, trato cortés, modales afectuosos y sinceros; garbo y vigor en gráciles miembros. Religioso sin intolerancia, docto sin pedantería, sabio sin ostentación, enemigo del fasto, despreocupado por la riqueza, sin ambición a los honores, desconocedor de sus méritos y reputación, modesto, sobrio, afectuoso.
La actividad científica
La carrera científica de Avogadro se encuentra íntimamente ligada a los estudios sobre la electricidad realizados por Volta. Entre 1806 y 1807 el químico turinés publicó una memoria sobre los cuerpos aislantes, posteriormente denominados dieléctricos por Faraday. Avogadro admitió que en dichos cuerpos se generan alternadamente estados moleculares negativos y positivos que acaban volviéndolos neutros en su conjunto. Dedujo, además, que todos los fenómenos eléctricos pueden resumirse en fenómenos químicos. Algunos años más tarde se interesó por el concepto de acidez de base de las sustancias y describió los hidrácidos como ácidos sin oxígeno. Estableció la primera tabla de potenciales electroquímicos de los elementos, distribuyendo los ya conocidos en una sucesión en cuyos extremos se encontraban respectivamente los elementos más electronegativos y los más electropositivos.
Cuando en 1808 Gay-Lussac (1778-1850) enunció las leyes de combinación de los elementos en estado gaseoso (Proust [1754-1826) había publicado la ley de las proporciones definidas en 1801), Avogadro relacionó éstas con la hipótesis atómica de John Dalton (1766-1844), publicada en el New System of Chemical Philosophy (1808).
Sus reflexiones dieron por fruto una memoria publicada en 1811, titulada en francés: Essai d'une manière de déterminer les masses relatives des molécules élementaires des corps et les proportions selon lesquelles elles entrent dans ces combinaisons.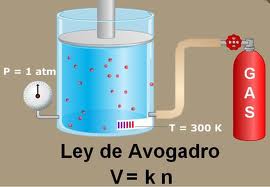
Los años comprendidos entre 1800 y 1811 fueron, sin lugar a duda, sumamente fecundos para la química y la ciencia en general. Tales progresos pudieron realizarse gracias a la obra de Lavoisier (1743-1794), quien en los últimos años del siglo XVIII había perfeccionado y completado sus estudios sobre combinación de los elementos en estado sólido, la combustión y la conservación de la masa en las reacciones químicas. (Recuérdese la publicación, en 1787 y 1789 en Francia, de los volúmenes Méthode de Nomenclature Chimique, de Lavoisier, Morveau, Berthollet, Fourcroy, y el Traité élémentaire de Chimie del mismo Lavoisier).
Particular reflexión merece la teoría atómica de Dalton, la cual aparece precisamente como una fundamental conquista conceptual de la nueva química que se estaba construyendo gradual pero rápidamente por entonces. Recuérdese que con ella renacía la antigua teoría de los griegos Demócrito y Leucipo, examinadas ahora a la luz de los nuevos descubrimientos de la física y la química de Lavoisier. En síntesis, tal teoría afirmaba que: dado que en los compuestos que forman, los diversos elementos aparecen siempre según valores de peso bien definidos, enteros y nunca fraccionarios, tales valores deben ser necesariamente múltiplos de pesos muy pequeños, pero no nulos, característicos de cada uno de los elementos. Tales pesos deben por tanto corresponderse con el peso de una partícula indivisible, llamada átomo, típica de cada elemento.
La novedad conceptual de esta teoría radica en admitir que todos los elementos están constituidos por átomos indivisibles, de diferentes pesos, y que las reacciones químicas se producen por simple combinación de partículas elementales de elementos diferentes. Por consiguiente, según Dalton, un átomo de hidrógeno reacciona con un átomo de oxígeno para dar una molécula de agua; un átomo de nitrógeno con uno de hidrógeno para dar una molécula de amoníaco. Estos simples ejemplos dejan translucir la dificultad de Dalton en establecer las precisas relaciones combinatorias entre los elementos en estado gaseoso que participaban en las reacciones anteriormente descritas.
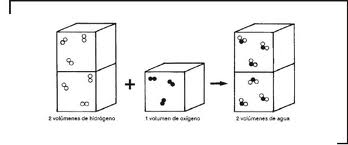
El problema fue resuelto por dos experimentadores de gran talento: el ya mencionado Joseph Louis Gay-Lussac, profesor de física y química en la Universidad de la Sorbona de París, y el naturalista y geógrafo alemán Alexander von Humboldt (1769-1859). El geógrafo alemán, por aquellos primeros años del siglo XIX, se interesaba por la composición del aire y del agua. Le interesaba muy particularmente determinar las exactas proporciones de oxígeno e hidrógeno presentes en el líquido elemento. En sus experimentos había utilizado el método de la combustión del hidrógeno con el oxígeno sugerido po Volta, pero los resultados obtenidos eran contradictorios.  Decidió entonces recurrir a Gay-Lussac para proponerle encarar juntos el problema. El resultato de sus estudios conjuntos fue una memoria publicada en 1805, en la que ambos estudiosos demostraron que la relación combinatoria entre los dos gases, en la formación de la molécula de agua, era de 2 volúmenes de hidrógeno u 1 volumen de oxígeno, y que estos tres volúmenes de gas daban 2 volúmenes de vapor de agua. Semejante resultado fue importante, no sólo como brillante conquista experimental, sino principalmente porque suscitaba grandes divergencias entre los químicos de la época, una profunda disonancia respecto de todo el aparato teórico construido hasta entonces.
Decidió entonces recurrir a Gay-Lussac para proponerle encarar juntos el problema. El resultato de sus estudios conjuntos fue una memoria publicada en 1805, en la que ambos estudiosos demostraron que la relación combinatoria entre los dos gases, en la formación de la molécula de agua, era de 2 volúmenes de hidrógeno u 1 volumen de oxígeno, y que estos tres volúmenes de gas daban 2 volúmenes de vapor de agua. Semejante resultado fue importante, no sólo como brillante conquista experimental, sino principalmente porque suscitaba grandes divergencias entre los químicos de la época, una profunda disonancia respecto de todo el aparato teórico construido hasta entonces.
Tal como veremos a continuación, partiendo de estos datos experimentales, aparentemente contradictorios, (¿cómo habrían podido tres volúmenes de gas reactivos dar tan sólo dos volúmenes de gas producidos?), Avogadro consiguió formular su brillante hipótesis.
La gran simplicidad de las relaciones combinatorias impulsó a Gay-Lussac a continuar solo sus experimentos, utilizando otros gases y determinando las respectivas relaciones combinatorias (entre un volumen de cloro y uno de hidrógeno para dar dos volúmenes di ácido clorhídrico; entre dos volúmenes de nitrógeno y uno de oxígeno para dar dos volúmenes de protóxido de nitrógeno, etc.). Los resultados de sus estudios fueron recogidos, como ya hemos dicho, en la publicación de 1808, titulada: Sur les combinaisons des substances gazeuses les unes avec les autres.
Sin embargo, la teoría daltoniana de los átomos indivisibles no podía concordar con los resultados de Gay-Lussac. Las relaciones simples de los volúmenes de combinación no se explicaban si se admitía que los elementos gaseosos sólo podían encontrarse en estado atómico. Por otra parte, la teoría del químico inglés había encontrado en Jons Jacob Berzelius (1779-1848) un tenaz sostenedor. En una publicación de 1812, Berzelius, inspirándose en los estudios de A. Volta, afirmó que no podían existir moléculas de elementos gaseosos, como el hidrógeno, el oxígeno o el nitrógeno, por cuanto los átomos se agregaban siguiendo las leyes de la electroestática, es decir comportándose algunos como positivos y otros, como negativos. La tenaz oposición ante la teoría atómica del químico sueco Berzelius, que gozaba de indiscutida autoridad en la comunidad científica internacional, fue la principal causa de la conjura de silencio que tuvo lugar en menoscabo de Amedeo Avogadro.
Tal era el panorama conceptual, variado y científicamente estimulante, en que se enmarcaba la actividad del químico turinés. En un informe acerca de las principales etapas del desarrollo de la química del siglo XVIII, el químico sueco Arrhenius (1859-1927) escribe que las dificultades suscitadas por los experimentos de Gay-Lussac, la teoría atómica de Dalton y la de Berzelius fueron superadas en forma bastante simple pero brillante por el químico italiano Amedeo Avogadro. Este, basándose en una intuición genial, concibió que los gases no estaban constituidos por un solo orden de partículas, sino por dos. Así pues, resultaba que todos los gases estaban constituidos por moléculas, las que a su vez estaban constituidas por una, dos o más moléculas elementales, o sea los átomos. Afirmó además que volúmenes iguales de gases diferentes, sometidos a idénticas condiciones de presión y temperatura, contienen el mismo número de moléculas.
Tras analizar nuevamente la ley de los volúmenes de Gay-Lussac, Avogadro la reformula en los siguientes términos: Cuando los gases reaccionan entre sí en relaciones simples de volumen, reaccionan en relaciones simples de moléculas, por tanto decir moléculas y decir volúmenes es lo mismo, a lo cual añade: Las relaciones entre los pesos de volúmenes iguales nos dan la densidad, por tanto las densidades de los gases son proporcionales a los pesos de las moléculas.
El químico turinés explica la combinación de las diversas moléculas integrantes imaginando que éstas se separan en los átomos de Dalton, y que de esta manera dan nuevas combinaciones según las relaciones simples de Gay-Lussac. De las consideraciones de Avogadro, se desprende la definición de molécula: Se entiende por molécula el más pequeño agregado de átomos, iguales o diferentes, capaces de existir indipendientemente y poseer todas las propriedades químicas y físicas de la sustancia que se encuentra constituida por un conjunto de moléculas.
 Una inmediata aplicación práctica de la hipótesis de Avogadro la proporciona la determinación de las masas moleculares y atómicas relativas de las diversas sustancias en estado gaseoso. Una vez establecido que volúmenes iguales de gases diferentes, en idénticas condiciones de presión y temperatura, contienen el mismo número de moléculas, se deriva que la relación entre las masas de gases de iguales volúmenes permite confrontar los pesos de las partículas individuales contenidos en ellas.
Una inmediata aplicación práctica de la hipótesis de Avogadro la proporciona la determinación de las masas moleculares y atómicas relativas de las diversas sustancias en estado gaseoso. Una vez establecido que volúmenes iguales de gases diferentes, en idénticas condiciones de presión y temperatura, contienen el mismo número de moléculas, se deriva que la relación entre las masas de gases de iguales volúmenes permite confrontar los pesos de las partículas individuales contenidos en ellas.
En una memoria de 1821,el químico turinés, abocado al estudio de las reacciones en estado gaseoso, logra definir el concepto de equivalencia de los átomos. Así, por ejemplo, considerando las relaciones combinatorias, un átomo de cloro equivale a un átomo de hidrógeno; un átomo de oxígeno equivale a dos de hidrógeno o a dos de cloro; un átomo de nitrógeno equivale a tres de hidrógeno y así sucesivamente. El concepto de equivalencia permite comprender que las reacciones químicas se producen por intercambio recíproco de moléculas de los diferentes elementos y, además, proporciona una confirmación indirecta de la validez de las leyes de ponderales y volumétricas de Proust y Gay-Lussac.
La obra científica de Avogadro no se limita, como suele decirse en los manuales de química, a la conocida teoría molecular, sino que constituyó una contribución sumamente importante a los estudios de electroquímica, como también a los problemas estrictamente físicos, como la capilaridad, la viscosidad y la tensión de vapor. Estudió el estado sólido y el líquido, las soluciones de sólidos en líquidos y de sólidos en sólidos, además de la particular constitución molecular del carbono, y las relaciones existentes ente las propiedades físicas y químicas de los gases. Se interesó en los compuestos del silicio y del boro, y determinó con exactitud las primeras fórmulas químicas de los metales alcalinos y alcalinos terrosos. Por otra parte, la física fue uno de sus campos de investigación privilegiados, pues precisamente estaba convencido de que muchos de los fenómenos químicos sólo podían explicarse por medio oportunas consideraciones físicas. Su ponderado tratado en cuatro volúmenes Fisica de' corpi ponderabili o Trattato della costituzione generale de' corpi, publicado entre 1837 y 1841, fue considerado el primer texto de física técnica. Los volúmenes son de fácil lectura, escritos en forma lineal, clara y rigurosa. La obra está dedicada al rey Carlos Alberto, el cual había aprobado su publicación y apoyado los considerables gastos tipográficos.
ponderado tratado en cuatro volúmenes Fisica de' corpi ponderabili o Trattato della costituzione generale de' corpi, publicado entre 1837 y 1841, fue considerado el primer texto de física técnica. Los volúmenes son de fácil lectura, escritos en forma lineal, clara y rigurosa. La obra está dedicada al rey Carlos Alberto, el cual había aprobado su publicación y apoyado los considerables gastos tipográficos.
En la historia de la ciencia, el caso Avogadro constituye un ejemplo más que elocuente de cómo un trabajo científico de suma importancia puede no ser reconocido, ser ocultado y luego olvidado durante muchos años. En Italia, hasta 1901, ningún libro o publicación sobre química y física citaba la aportación científica de 1811 del químico turinés. Semejante omisión cobra un significado especialmente negativo para la ciencia italiana, sobre todo si se tiene en cuenta que la memoria de Avogadro ya se había traducido al inglés y al francés, tal como lo recuerda el Prof. Icilio Guareschi en su discurso conmemorativo del 24 de septiembre de 1911. En Italia, por el contrario, circulaban, desde hacía mucho tiempo, los escritos del físico francés Ampère (1775-1836). Precisamente, Guareschi pone de relieve la soledad y la amargura de un hombre que muere a los ochenta años de edad, sin haber visto el reconocimiento debido al valor de sus estudios. Tampoco ningún químico o físico considera, en aquella ocasión del 9 de julio de 1856, deber pronunciar algunas palabras por la actividad del científico. En 1857 fueron dos de sus alumnos, Botto y Chiò, quienes recordaron la obra del maestro y propusieron se erigiera en su honra un busto de mármol en el interior de la Universidad de Turín. A pesar de todo, en aquella ocasión tampoco ningún catedrático o funcionario de prestigio tomó la palabra para recordar al científico.
Avogadro ha sido considerado como un poeta de la ciencia. Su carácter reservado, su humildad condicen con tal consideración.
Pertenece a la estirpe de los grandes hombres que con su apasionada imaginación, sus sueños y su saber, han contribuido en suma medida con el progreso de los conocimientos científicos. Guareschi equipara a Avogadro con Newton, Keplero, Lavoisier, Augusto Kekulé. Avogadro, afirma Guareschi, no nos ha dicho cómo llegó a hipotetizar las moléculas de los gases, qué visiones o sueños ayudaron su inteligencia cuando definió el principio que lleva su nombre.
A tal propósito, situándonos en la actualidad, es oportuno recordar lo que Peter B. Medawar, premio Nobel de medicina de 1968, expresa en su libro Los límites de la ciencia, publicado por Boringhieri en 1985: la actividad científica siempre nace de un acto de imaginación, de una aventura del pensamiento. Medawar nos recuerda asimismo que fue B. P. Shelley quien propuso la palabra Poiesis, la cual se adapta perfectamente a la actividad del poeta y del científico. Significa poesía, pero también acto creativo, producción. Por otra parte, el epistemólogo Paul Feyerabend (1924-1994) sostiene que: En el campo de la ciencia, las grandes revoluciones se han dado porque algunos científicos se valieron de hipótesis que contrastaban con la visión científica de tal o cual momento histórico. El mundo de los sueños de Galileo, por ejemplo, contrastaba con el mundo de los conocimientos aristotélicos universalmente aceptados durante siglos. (Contro il metodo, 1979, Feltrinelli).
 Las pruebas que demostraron la teoría de Avogadro, cuando ésta fue formulada, no parecieron suficientes a los químicos de la época para aceptar el concepto de molécula. Con el correr del tiempo, se fueron acumulando por cierto muchos datos experimentales, pero por falta de una teoría adecuada que los reuniera en una visión unificadora, se produjo una gran confusión que paralizó los progresos de la química durante unos cincuenta años. En 1860, tal como lo recuerda H.M.Leicester en su Storia della Chimica (ed. ISEDI), se había llegado al punto de que los químicos escribían fórmulas diferentes según la escuela a la que pertenecieran. Kekulé demostró particular interés por el problema, y se afanó en organizar un congreso de químicos de todos los países, para procurar poner orden en la nomenclatura química. Su amigo Carl Weltzien (1813-1870) compartió la idea de convocar un congreso de química en Karlsruhe y el químico orgánico Charles Wurtz (1817-1884) se sumó al grupo de los organizadores.
Las pruebas que demostraron la teoría de Avogadro, cuando ésta fue formulada, no parecieron suficientes a los químicos de la época para aceptar el concepto de molécula. Con el correr del tiempo, se fueron acumulando por cierto muchos datos experimentales, pero por falta de una teoría adecuada que los reuniera en una visión unificadora, se produjo una gran confusión que paralizó los progresos de la química durante unos cincuenta años. En 1860, tal como lo recuerda H.M.Leicester en su Storia della Chimica (ed. ISEDI), se había llegado al punto de que los químicos escribían fórmulas diferentes según la escuela a la que pertenecieran. Kekulé demostró particular interés por el problema, y se afanó en organizar un congreso de químicos de todos los países, para procurar poner orden en la nomenclatura química. Su amigo Carl Weltzien (1813-1870) compartió la idea de convocar un congreso de química en Karlsruhe y el químico orgánico Charles Wurtz (1817-1884) se sumó al grupo de los organizadores.
El primer congreso de química comenzó el 3 de septiembre de 1860. Los trabajos del encuentro científico tuvieron como indiscutido protagonista al químico palermitano Stanislao Cannizzaro (1826-1910), profesor de la Universidad de Génova, quien conocía perfectamente la hipótesis de su compatriota Avogadro. Cannizzaro había publicado un compendio del curso dictado en la universidad, en el que, en un lenguaje claro y vigoroso exponía los resultados de las aplicaciones de la teoría molecular. En las sesiones del congreso, el químico palermitano ilustró el documento por medio de intervenciones llenas de ardoroso entusiasmo, tendientes a convencer a los escépticos de la indiscutible validez del trabajo de su compatriota. Al finalizar la sesión, su amigo Angelo Pavesi, de la Universidad de Pavía, distribuyó entre todos los químicos presentes la reedición del compendio de Cannizzaro, titulado Nuovo Cimento. En la mencionada memoria, el químico palermitano reconstruía las etapas del trabajo de Avogadro y presentaba una tabla actualizada de los pesos moleculares de varios compuestos. Otro convencido sostenedor de la hipótesis molecular fue el físico alemán Lothar Meyer (1814-1887),  quien publicó en Breslavia un libro sobre la nueva química propuesta por Cannizzaro, libro que tuvo gran aceptación en el mundo académico internacional. En esta publicación se consignaba la propuesta de Cannizzaro, aprobada por el congreso de Karlsruhe: Se propone que se adopten conceptos diferentes para molécula y átomo, considerándose molécula la cantidad más pequeña de sustancia que entra en reacción conservando sus características físicas, y entiendéndose por átomo la más pequeña cantidad de un cuerpo que entra en la molécula de sus compuestos.
quien publicó en Breslavia un libro sobre la nueva química propuesta por Cannizzaro, libro que tuvo gran aceptación en el mundo académico internacional. En esta publicación se consignaba la propuesta de Cannizzaro, aprobada por el congreso de Karlsruhe: Se propone que se adopten conceptos diferentes para molécula y átomo, considerándose molécula la cantidad más pequeña de sustancia que entra en reacción conservando sus características físicas, y entiendéndose por átomo la más pequeña cantidad de un cuerpo que entra en la molécula de sus compuestos.
Por fin, en una ocasión oportuna y prestigiosa como la del primer congreso internacional de química, y gracias al generoso empeño de otro científico italiano, se dio el merecido reconocimiento al trabajo de Amedeo Avogadro. La conmemoración de 1911 contó con la intervención di científicos de toda Europa. Nos limitaremos a citar aquí al Prof. Walter Hermann Nernst, de la Universidad de Berlín, premio Nobel de química en 1920, Albin Haller, profesor de la Sorbona y miembro de la Academia Francesa de Ciencias, Adriano Ostrogovich, de la Universidad de Bucarest, Silvio Rebello, de la Sociedad portuguesa de naturalistas. Aquel día, todo el mundo científico tenía la mirada puesta en Turín y todos los participantes estaban al parecer conscientes de haber sido convocados a reparar un daño, y anular una manifiesta injusticia.
